K. T. Chandrashekar, профессор и руководитель, и
Chhavi Saxena, аспирант
Отделение паридонтологии, стоматологический колледж Darshan, Удайпур, Раджастхан, Индия
Аннотация
Цель исследования:
Определение эффективности Biograft-HT® в качестве материала для костных трансплантатов при лечении распространённых вертикальных дефектов у пациентов с хроническим периодонтитом, и его клинические и рентгенологические оценки.
Пациенты и методы:
Для данного исследования были выбраны двадцать пациентов с диагнозом хронический периодонтит с двумя или более вертикальными дефектами. Такие клинические параметры, как индекс налета, индекс гингивита, глубина кармана зондирования и уровни клинического прикрепления регистрировались в различные моменты времени в течение шести месяцев. Рентгенографическая оценка включала проверку глубины дефекта кости и процент заполнения костных дефектов и проводилась для обеих групп в начале исследования, через три месяца и шесть месяцев. После регистрации клинических параметров и проведения первой фазы терапии, места дефектов были случайным образом обработаны либо с использованием Biograft-HT® или просто хирургической обработкой раны с использованием свободных лоскутов.
Результаты:
Через шесть месяцев произошло значительное сокращение значений индекса налета и гингивита в обеих исследуемой и контрольной группах. Было зарегистрировано 64%-е снижение глубины кармана зондирования для тестовой зоны по сравнению с 54,52%-м снижением в контрольной группе. Точно так же был зарегистрирован 84,82%-е увеличение уровня клинического прикрепления с момента проведения операции до истечения шести месяцев после операции в экспериментальной группе по сравнению с 68,83%-м увеличением в контрольной группе. Кроме того, наблюдался уровень 43,57% костного заполнения в экспериментальной зоне, тогда уровень костного заполнения в контрольной зоне составлял только 17,98%.
Вывод:
Biograft-HT улучшает заживление, приводит к уменьшению глубины зондирования, исправлению костных дефектов и усилению клинического прикрепления по сравнению с открытой хирургической обработкой с использованием свободных лоскутов.
Ключевые слова:
Бета-трикальцийфосфат, гидроксиапатиты, вертикальные дефекты
Введение
Заболевание пародонта является одним из самых распространенных заболеваний в мире. Бактериальный налет является основным причинным фактором инициирования и прогрессировании воспалительных заболеваний пародонта. Заболевание пародонта приводит к потере аппарата периодонтальных связок, в том числе к потере альвеолярной кости, удерживающей зуб. Несмотря на то, что пародонтит является инфекционным заболеванием ткани десен, изменения, которые происходят в костях, имеют критическое значение, потому что разрушение костей ведет к потере зубов.[
1]
Цель периодонтальной терапии – это устранение воспаления тканей пародонта для прекращения разрушения мягких тканей и костей, вызванного заболеваниями пародонта, а также – регенерация утраченных тканей, если это возможно.[
2]
Костная пластика – это наиболее распространенная форма восстановительной терапии, она используется на протяжении почти 100 лет в попытках стимулировать заживление костных дефектов. Первая попытка использования костного трансплантата была выполнена голландским хирургом Job van Meckren в 1668 году. Тем не менее, первое использование костного трансплантата для восстановления потери костной массы при заболевании пародонта датируется 1923 годом (Hegedus). Такие материалы, как гипс, гетерогенная костяная мука и другие костные составы также были опробованы для имплантации в костные дефекты пародонта в 1930-х годах.[
3]
Аллопластические материалы костных трансплантатов – это синтетические, неорганические, биосовместимые и биоактивные костные заменители, которые, как полагают, способствует заживлению костных дефектов за счет остеокондуктивности.
Несколько биоматериалов на основе фосфата кальция были протестированы с середины 1970-х годов. Они обладают отличной совместимостью с тканями и не вызывают никаких воспалений или реакций на инородные тела.[
4,
5] Используется два типа керамики на основе фосфата кальция – гидроксиапатиты и трехкальциевые фосфаты.[
6–
8]
Biograft-HT® (производства компании IFGL Bioceramics Limited, Калькутта) – это двухфазный фосфат кальция, состоящий из гидроксиапатита и бета-трикальцийфосфата в процентном соотношении по весу примерно 70:30. Этот материал биосовместимый, нетоксичный, рассасывающийся, невоспалительный и биоактивный. Он не вызывает иммунологических реакций, реакций на инородные тела или раздражений и имеет отличные остеокондуктивные свойства.
Целью данного клинического исследования было оценить данный новый материал костного трансплантата Biograft-HT® при лечении внутрикостных дефектов и провести его клиническую и рентгенологическую оценку
Пациенты и методы
Для данного исследования были выбраны двадцать пациентов (с тридцатью дефектами) с диагнозом хронический периодонтит с двумя или более вертикальными дефектами из амбулаторного отделения пародонтологии стоматологического колледжа Даршан, Удайпур (Раджастхан).
Критерии отбора
Критерии включения
- Пациенты с диагнозом хронический периодонтит с глубиной зондирования ≥5 мм и рентгенологическими признаками потери вертикальной костной массы
- Возрастная группа 35-55 лет.
- Пациенты с хорошим общим состоянием здоровья, без каких-либо системных заболеваний
Exclusion criteria
- Пациенты с неприемлемой гигиеной полости рта во время предоперационного (фаза I) периода
- Беременные женщины и кормящие матери
- Курильщики
- Пациенты с системным нарушением состояния здоровья
План исследования
Пациенты подписали письменную форму информированного согласия, объясняющую характер исследования и хирургические процедуры. Терапия фазы I состояла из выполнения строгой гигиены ротовой полости, снятия зубных отложений, выравнивания поверхности корней и назначения полоскания рта хлоргексидином. Состав пациентов был пересмотрен после терапии фазы
I. Базовые записи клинических параметров
Базовые измерения включали индекс налёта, индекс гингивита, глубину кармана зондирования и уровень клинического прикрепления (с помощью зонда UNC-15 с окклюзионным стентом).
Радиографические параметры
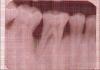
Была выполнена интраоральная периапикальная рентгенограмма зоны каждого дефекта с помощью техники использования длинных параллельных конусов. Для изучения была выбрана зона нижнего моляра (нижней челюсти). Облучение проводилось при пиковом напряжении 70 KVP, 8 мА, 0,6 сек с собственной фильтрацией 2 мм AL, пленка Kodak E-speed plus. Расстояния пленка-объект и фокусное пятно-объект были стандартизированы до 20 см. Оцифрованные изображения отображались на мониторе с 5-кратным увеличением с использованием программного обеспечения Adobe Photoshop 7.0. Сетка 0,5 мм была нанесена на оцифрованные изображения, все линейные измерения были произведены с помощью программного обеспечения Auto-CAD 2006 [Рисунки
1a и
2a].
Рисунок 1a Рентгенограмма контрольной зоны в начале исследования
Рисунок 2a Рентгенограмма экспериментальной зоны в начале исследования
Предварительный хирургический протокол
После первоначального осмотра и обсуждения плана лечения, все выбранные пациенты получили подробные инструкции о хирургической процедуре, а затем прошли снятие зубных отложений, выравнивание поверхности корней и кюретаж с устными инструкциями о гигиене. Где это было показано, был проведен окклюзионный контакт; после начальной терапии была проведена переоценка.
Все пациенты прошли регулярный анализ крови, который включал гемоглобин, время кровотечения, время свертывания крови, общий подсчёт лейкоцитов, дифференциальный подсчёт лейкоцитов и сахар в крови. Также был проведен тест ИФА на ВИЧ и гепатит.
Все участки лечения были исследованы для регистрации клинических и радиографических параметров.
Хирургический протокол
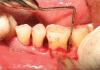
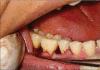
Выбранные участки были случайным образом отнесены к экспериментальным или контрольным. После соответствующей местной анестезии, были сделаны десневые разрезы, и место дефекта было раскрыто с помощью слизисто-надкостничного лоскута полной толщины, была проведена санация раневой полости пораженной грануляционной ткани с последующим тщательным выравниванием поверхности корней и спринцеванием физиологическим раствором [Рисунок
3a].
Экспериментальная зона с вертикальным дефектом
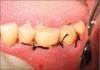
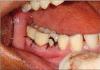
На экспериментальных участках дефект был заполнен частицами Biograft-HT® (синтетический гидроксиапатит и бета-трикальцийфосфат). Необходимое количество материала трансплантата было помещено в специальную посуду, смешано с физиологическим раствором, и постепенно перенесено в костный дефект с помощью скалера Cumine (Hu-Friedy). Материал размещался от основания дефекта коронарно приблизительно до уровня гребня или оставшейся костной стенки [Рисунок
3b]. Участок операции был закрыт черными шелковыми швами 4-0 [Рисунок
3c] и защищен составом без эвгенола.
Экспериментальный участок с костным трансплантатом
Экспериментальный участок после наложения швов
Контрольные участки были оставлены незаполненными после хирургической санации, тщательного выравнивания поверхности корней, и орошение операционной раны было сделано с помощью физиологического раствора [Рисунок
4a]. Слизисто-надкостничные лоскуты были перемещены и закреплены на месте с помощью черных плетеных (4-0) узловых шелковых швов для первичного закрытия межзубного пространства [Рисунок
4b], и защищены составом без эвгенола. Всем пациентам было назначено обезболивающее диклофенак-натрий по 50 мг два раза в день и амоксициллин по 500 мг три раза в день в течение пяти дней.
Контрольный участок с дефектом после санации
Контрольный участок после наложения швов
Послеоперационный протокол
Через неделю после операции швы и повязки были сняты, место операции было тщательно промыто физиологическим раствором. Так как лечение прошло удовлетворительно, и ни один из пациентов не испытывал каких-либо неблагоприятных реакций, повторные визиты были назначены на срок через один, три и шесть месяцев. Во время каждого визита, проводились устные инструкции по гигиене, а прооперированные участки профессионально промывались физиологическим раствором.
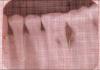
Спустя три и шесть месяцев после окончания терапии состояние пациентов было оценено клинически и рентгенологически. Клинические параметры (индекс налета, индекс гингивита, глубина кармана зондирования, уровень клинического прикрепления) и рентгенографические измерения были проверены для контрольных и экспериментальных участков [Рисунки
1b и
2b].
Рентгенограмма контрольного участка через шесть месяцев
Рентгенограмма экспериментального участка через шесть месяцев
РЕЗУЛЬТАТЫ
Основная цель лечения пародонта – это сохранение здоровья и комфортного функционирования ряда естественных зубов. Когда парадонтоз приводит к ослаблению аппарата прикрепления зубов, терапия направлена на восстановление периодонтального прикрепления, включая формирование нового цементного вещества зубов, функционально ориентированной периодонтальной связки и альвеолярной кости на поверхности корня.
Настоящее клиническое исследование было направлено на оценку эффективности Biograft-HT® в качестве материала для костной пластики при лечении вертикальных дефектов у пациентов с хроническим периодонтитом, и на сравнение его эффективности с хирургической обработкой раны с использованием свободных лоскутов. Biograft-HT® представляет собой новый материал костного трансплантата, состоящий из гидроксиапатита и бета-трикальцийфосфата в соотношении 70:30. Размер частиц материала трансплантата был 250 микрон.
Индекс налёта
Не было обнаружено статистически значимых различий в средних значениях индекса налета в опытной и контрольной группах в начале исследования (P = 0,173), через один месяц (P = 0,956), через три месяца (P = 0,729) и шесть месяцев (P = 0,181) [
Таблица 1].
Средний индекс налета до и после лечения
Таблица 1
|
Индекс налета
|
Контрольная группа
|
Экспериментальная группа
|
Значение P
|
|
|
|
|
|
|
|
Средн.±среднекв. откл.
|
% Изменение от нач. ур. (%)
|
Средн.±среднекв. откл.
|
% Изменение от нач. ур. (%)
|
|
|
До операции
|
1.465 ± 0.128
|
-
|
1.397 ± 0.136
|
-
|
0.173
|
|
1 месяц
|
1.203 ± 0.198
|
17.88
|
1.207 ± 0.193
|
13.60
|
0.956
|
|
3 месяца
|
0.844 ± 0.196
|
42.38
|
0.819 ± 0.190
|
41.37
|
0.729
|
|
6 месяцев
|
0.655 ± 0.174
|
55.29
|
0.575 ± 0.144
|
58.84
|
0.181
|
|
Значение P
|
<0.000**
|
<0.000**
|
|
Индекс гингивита
Не было обнаружено статистически значимых различий в средних значениях индекса гингивита в опытной и контрольной группах в начале исследования (P = 0.069), через месяц (P = 0.050), через три месяца (P = 0.060) и шесть месяцев (P = 0.172) [
Таблица 2].
Средний индекс гингивита до и после лечения
Таблица 2
|
Индекс налета
|
Контрольная группа
|
Экспериментальная группа
|
Значение P
|
|
|
|
|
|
|
|
Средн.±среднекв. откл.
|
% Изменение от нач. ур.
|
Средн.±среднекв. откл.
|
% Изменение от нач. ур.
|
|
|
До операции
|
1.09 ± 0.2134
|
-
|
0.9407 ± 0.2190
|
-
|
0.069
|
|
1 месяц
|
0.9013 ± 0.1932
|
17.31
|
0.7627 ± 0.1779
|
18.92
|
0.050*
|
|
3 месяца
|
0.6973 ± 0.1102
|
36.02
|
0.6173 ± 0.1129
|
34.37
|
0.060
|
|
6 месяцев
|
0.5220 ± 0.114
|
52.11
|
0.4713 ± 0.0850
|
49.89
|
0.172
|
|
Значение P
|
<0.000**
|
<0.000**
|
|
Глубина кармана зондирования
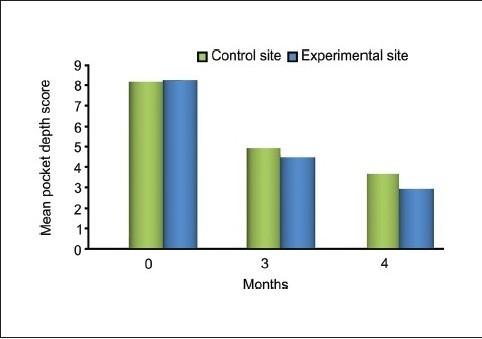
Не было обнаружено статистически значимых различий в опытной и контрольной группах в начале исследования (P = 0.646) и через три месяца (P = 0.109). Однако средние значения через шесть месяцев (P = 0.014) были очень значительные. Уменьшение глубины зондирования экспериментального участка с периода до операции до шести месяцев после операции составило 64.26% по сравнению с контрольной группой, в которой уменьшение составило 54.52% [Таблица 3 и График1].
Таблица 3
|
Глубина кармана зондирования
|
Контрольная группа
|
Экспериментальная группа
|
Значение P
|
|
|
|
|
|
|
|
Средн.±среднекв. откл.
|
% Изменение от нач. ур.
|
Средн.±среднекв. откл.
|
% Изменение от нач. ур.
|
|
|
До операции
|
8.07 ± 0.88
|
-
|
8.20 ± 0.68
|
-
|
0.646
|
|
3 месяца
|
4.93 ± 0.70
|
38.90
|
4.47 ± 0.83
|
45.48
|
0.109
|
|
6 месяцев
|
3.67 ± 0.72
|
54.52
|
2.93 ± 0.80
|
64.26
|
0.014*
|
|
Значение P (До операции-3 месяца)
|
0.000**
|
0.000**
|
|
|
Значение P (До операции-6 месяцев)
|
0.000**
|
0.000**
|
|
Сравнение средней клинической глубины кармана зондирования между экспериментальными (синий цвет) и контрольными (зеленый цвет) участками.
Клиническое прикрепление
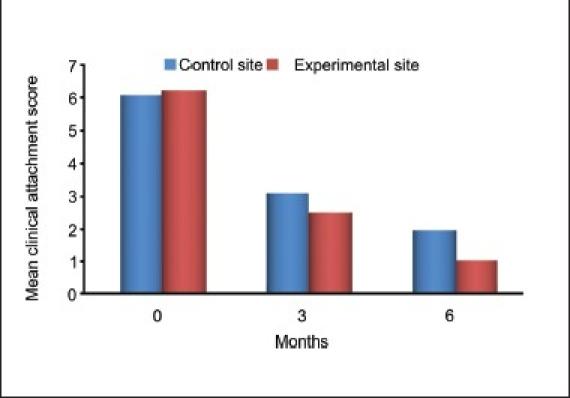
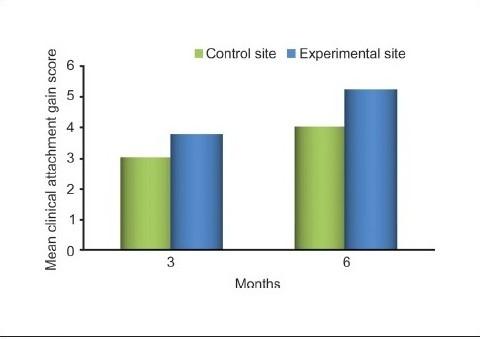
Разница между средними значениями уровня клинического прикрепления в исходном состоянии (P = 0,65) в опытной и контрольной группах была незначительной. Тем не менее, различия в средних значениях уровня клинического прикрепления через три (P = 0,036) и шесть месяцев (P <0,001) были статистически значимыми. Такое увеличение уровня клинического прикрепления от исходного состояния до состояния через шесть месяцев после операции составляло 84,82% в экспериментальной группе и 68,83% в контрольной группе [Таблица 4 и Графики
2 и
3].
Таблица 4
|
Уровень клинического прикрепления
|
Контрольная группа
|
Экспериментальная группа
|
Значение P
|
|
|
|
|
|
|
|
Средн.±среднекв. откл.
|
% Изменение от нач. ур.
|
Средн.±среднекв. откл.
|
% Изменение от нач. ур.
|
|
|
До операции
|
6.00 ± 0.85
|
|
6.13 ± 0.74
|
-
|
0.65
|
|
3 месяца
|
3.00 ± 0.65
|
50
|
2.40 ± 0.83
|
60.84
|
0.036*
|
|
6 месяцев
|
1.87 ± 0.64
|
68.83
|
0.93 ± 0.80
|
84.82
|
0.001**
|
|
Значение P (До операции-3 месяца)
|
<0.000**
|
<0.000**
|
|
|
Значение P (До операции-6 месяцев)
|
<0.000**
|
<0.000**
|
|
*P<0.01- значимый
**P<0.001- высоко значимый
График 2
Средний уровень клинического прикрепления между экспериментальными (красный цвет) и контрольными (синий цвет) участками
Сравнение увеличения уровня клинического прикрепления между экспериментальными (синий цвет) и контрольными (зеленый цвет) участками
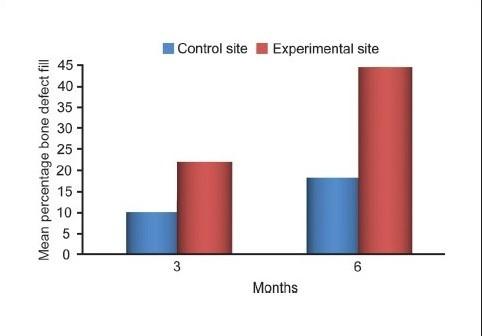
Объем заполнения костей в дефектах
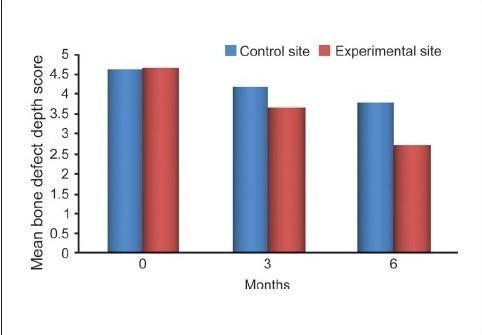
Для контрольных участков статистически значимая средняя разница в объеме заполнения дефектов от уровня до операции составляла 4,2000 ± 0,9783 мм (P = 0,212) через три месяца и 3,8000 ± 0,8619 мм (P = 0,014) через шесть месяцев. Для экспериментальных участков статистически значимая средняя разница в объеме заполнения дефектов от уровня до операции составляла 3,6667 ± 1,0293 мм (P = 0,013) через три месяца и 2,6333 ± 0,8958 мм (P <0,001) через шесть месяцев [Таблица 5 и
График 4].
Таблица 5
|
Глубина дефекта
|
Контрольная группа
|
Экспериментальная группа
|
Значение P
|
|
|
|
|
|
|
|
Средн.±среднекв. откл.
|
% Изменение от нач. ур.
|
Средн.±среднекв. откл.
|
% Изменение от нач. ур.
|
|
|
До операции
|
4.6333 ± 0.8756
|
-
|
4.6667 ± 1.0465
|
-
|
0.925
|
|
3 месяца
|
4.2000 ± 0.9783
|
09.35
|
3.6667 ± 1.0293
|
21.42
|
0.157
|
|
6 месяцев
|
3.8000 ± 0.8619
|
17.98
|
2.6333 ± 0.8958
|
43.57
|
0.001**
|
|
Значение P (До операции - 3 месяца)
|
<0.212
|
<0.013*
|
|
|
Значение P (До операции - 6 месяцев)
|
<0.014*
|
<0.000**
|
|
*P<0.01- значимый
**P<0.001- высоко значимый
Сравнение глубины костного дефекта между экспериментальными (красный цвет) и контрольными (синий цвет) участками
Различия в средних значениях объема заполнения дефектов от уровня до операции (P = 0,925) и через три месяца (P = 0,157) были незначительными, но разница была статистически значимой через шесть месяцев (P <0,001) между экспериментальной и контрольной группой [
График 5].
Сравнение процентного соотношения заполнения костных дефектов между экспериментальными (красный цвет) и контрольными (синий цвет) участками
ОБСУЖДЕНИЕ
Основная цель лечения пародонта – это сохранение здоровья и комфортного функционирования ряда естественных зубов. Когда парадонтоз приводит к ослаблению аппарата прикрепления зубов, терапия направлена на восстановление периодонтального прикрепления, включая формирование нового цементного вещества зубов, функционально ориентированной периодонтальной связки и альвеолярной кости на поверхности корня.
Сегодня доступны различные методы регенерации, включая биомодификацию поверхности корня зуба, управляемые методы регенерации тканей и использование костных трансплантатов. Управляемая регенерация тканей основана на принципе управления распространением различных компонентов тканей пародонта в процессе заживления после периодонтальной хирургии для достижения восстановления. Размещение барьерной мембраны (рассасывающейся или нерассасывающейся) между мягким лоскутом ткани и поверхностью корня способствует заполнению зоны раны, прилегающей к корню, регенеративными клетками из периодонтальной связки. Также доступны биологические посредники по улучшению клеточного заселения периодонтальной раны, в том числе пептидные последовательности, препараты белковых веществ и факторы роста для регенерации тканей на основе принципа имитации естественного процесса формирования зубов, которые обеспечивают спонтанное прохождение процесса регенерации каскада. Такие пептиды включают продукт Emdogain, богатую тромбоцитами плазму и т.д. Костные трансплантаты и костные заменители, используемые в восстановительной терапии, получают из костных или бескостных материалов, и коррекция потери альвеолярной кости происходит за счет явления остеокондукции.
В данном исследовании использовался синтетический заменитель кости, и сравнивались такие клинические параметры, как индекс налета, индекс гингивита, глубина кармана зондирования и уровень клинического прикрепления. Также была выполнена попытка сравнить результаты рентгенологически. Клинические параметры были зарегистрированы до операции, через три и шесть месяцев после операции. Настоящее исследование было шестимесячным и основано на концепции, что размерные изменения тканей пародонта в результате активной терапии происходят в течение первых шести месяцев. Самый надежный результат оценки периодонтальной регенерации – это гистологическое исследование человеческого организма, но оно исключено из-за практических и этических ограничений за счет связанных с ним осложнений.
Сравнительный анализ индексов налета контрольных и экспериментальных участков до операции показал значения 1,465 ± 0,128 и 1,397 ± 0,136 соответственно. Через шесть месяцев, среднее значение контрольного участка снизилось до 0,655 ± 0,174, тогда как значение экспериментального участка снизилась до 0,575 ± 0,144. Это привело к значению “t”, равному 1,371 (P <0,181), что указывает на незначительное различие между двумя участками. Однако изменения индексов налета от исходного уровня до уровня через шесть месяцев было значительным для опытных и контрольных участков, что можно отнести к строгому режиму гигиены рта, регулярным контрольным визитам и более строгим инструкциям по гигиене ротовой полости пациентов в течение периода исследования. Эти результаты сопоставимы с результатами предыдущих исследований по данным Oreamuno и др. [
9]
Сравнительный анализ индексов гингивита контрольных и экспериментальных участков до операции показал значения 1,0900 ± 0,2134 и 0,9407 ± 0,2190 соответственно (P <0,069), что свидетельствует о незначительной разнице между двумя участками. Через шесть месяцев, среднее значение контрольного участка снизилось до 0,5220 ± 0,1114, тогда как значение экспериментального участка снизилась до 0,4713 ± 0,1004 (P <0,172 между двумя участками). Это улучшение состояния десен может быть связано с операцией и часто проводимой поддерживающей терапией. Подобные результаты были получены у Yukna и др.[
10]
Сравнительный анализ глубины кармана зондирования контрольных и экспериментальных участков до операции показал значения 8,07 ± 0,88 и 8,20 ± 0,68 соответственно (P <0,646), что указывает на незначительное различие между двумя участками. Через три месяца после операции значения в среднем были равны 4,93 ± 0,70 для контрольных участков и 4,47 ± 0,83 для экспериментальных участков, что свидетельствует о малосущественных различиях (P <0,109). Через шесть месяцев среднее значение для контрольных участков снизилось до 3,67 ± 0,72, тогда как для экспериментальных участков – до 2,93 ± 0,80, что привело к значительным различиям (P <0,014) между двумя участками. Это уменьшение глубины зондирования в контрольной группе было меньше, чем в экспериментальной группе, что также было статистически значимо. Это хорошо согласуется с исследованиями, проведенными ранее Yukna и др., Kreji и др., Nery и др., Stahl и Forum и Galgut.[
4,
11–
14]
Сравнительный анализ уровня клинического прикрепления контрольных и экспериментальных участков до операции показал значения 6,00 ± 0,85 и 6,13 ± 0,74 соответственно (P <0,650). Через три месяца после операции значения были в среднем равны 3,00 ± 0,65 для контрольных участков и 2,40 ± 0,83 для экспериментальных участков, что указывает на значительное различие (P <0,036). Через шесть месяцев уровень клинического прикрепления для контрольных участков уменьшился до 1,87 ± 0,64, тогда как значение для экспериментального участка уменьшилось до 0,93 ± 0,80, что указывает на статистически высоко значимое различие (P <0,001). Сопоставимое увеличение уровня клинического прикрепления в контрольной группе может быть отнесено к формированию длинного эпителия соединительной связки вместо увеличения заполнения костной ткани и восстановления тканей, как в экспериментальной группе. Однако характер такого прикрепления не мог быть выявлен, так как требуется проведение гистологического исследования. Этот вывод согласуется с результатами исследований Nery и др., Galgut, Bowen и др. и Reynolds.[
13–
16]
Глубиной дефекта было расстояние от альвеолярного гребня до основания дефекта. Сравнительный анализ среднего процентного изменения заполнения дефекта для обоих участков выявил уровень заполнения около 43,57% для экспериментального участка и 17,98% для контрольного участка. Таким образом, на экспериментальном участке был более высокий процент заполнения дефекта, чем на контрольном участке, разница была статистически высоко значимой. Эти данные согласуются с результатами Nery и др., Stahl и Forum, Galgut, Meffert и др.[
4,
13,
14,
17,
18]
ВЫВОДЫ
Данная новая комбинация синтетического гидроксиапатита и бета-трикальцийфосфата (Biograft-HT®) оказалась биосовместимой и показала улучшение результатов лечения по сравнению с хирургической обработкой раны с использованием свободных лоскутов. Среди результатов – уменьшение глубины зондирования и увеличение уровня клинического прикрепления и объема заполнения дефектов костной тканью. Было выявлено значительное снижение уменьшение глубины кармана зондирования и увеличение уровня клинического прикрепления, как на экспериментальных, так и на контрольных участках. Тем не менее, на участках с имплантированным трансплантационным материалом было выявлено большее сокращение глубины кармана и более высокое увеличение уровня клинического прикрепления по сравнению с контрольными участками. Рентгенографическая оценка показала больший уровень заполнения дефектов на экспериментальных участках по сравнению с контрольной группой, что свидетельствует об эффективности трансплантационного материала. Хотя Biograft-HT® показал многообещающие результаты при клинической и рентгенологической оценке, необходимо провести дополнительные долгосрочные исследования с целью получения большего количества клинических данных для регулярного использования этого материала.
Примечания
Источник финансирования: нет
Конфликт интересов: не выявлено.
Cписок литературы
1. Carranaza FA, Newman MG. Reconstructive osseous surgery. 8th ed. Philadelphia, USA: WB Saunders Company; 1999. Clinical Periodontology; pp. 622–39.
2. Reynolds MA, Aichelmann-Reidy ME, Branch Mays GI, Gunsolley JC. The efficacy of bone replacement grafts in the treatment of periodontal osseous defects. Ann Periodontol. 2003;8:227–65. [
PubMed]
3. Nasr HF, Aichelmann Reidy, Yukna RA. Bone and bone substitutes. Periodontology 2000. 1999;19:74–86. [
PubMed]
4. Stahl SS, Froum S. Human intrabony lesion responses to debridement, porous hydroxyapatite implants and teflon barrier membranes. J Clin Periodontol. 1991;18:605–10. [
PubMed]
5. Kohad RM, Shetty S, Yeltiwar RK, Vaidya SN. A new synthetic hydroxyapatite – the right answer to bone regeneration. J Ind Soc Periodontol. 2001;4:6–11.
6. Jarcho M. Biomaterial aspects of calcium phosphates. Properties and applications. 1986;30:25–47.
7. Shetty V, Han TJ. Alloplastic materials in reconstructive periodontal surgery. Dent Clin of North Am. 1991;35:521–9. [
PubMed]
8. Silva RV, Camilli JA, Bertran CA, Moreiva NH. The use of hydroxyapatite and autogenous cancellous bone grafts to repair bone defects in rats. Int J Oral Maxillofacial Surg. 2005;34:178–84.
9. Oreamuno S, Lekovic V, Kenney EB, Carranza FA, Jr, Takei HH, Prokic B. Comparative clinical study of porous hydroxyapatite and decalcified freeze dried bone in human periodontal defects. J Periodontol. 1990;61:399–404. [
PubMed]
10. Yukna RA, Callan DP, Krauser JT, Evans GH, Aichelmann-Reidy ME, Moore K, и др. Multicenter clinical evaluation of combination anorganic bovine- derived hydroxyapatite matrix (ABM) / cell binding peptide (P-15) as a bone replacement graft material in human periodontal osseous defects. Six месяцs results. J Periodontol. 1998;69:655–63. [
PubMed]
11. Yukna RA, Krauser JT, Callan DP, Evans GH, Cruz R, Martin M. Thirty six месяц follow up of 25 patients treated with combination of anorganic bovine derived hydroxyapatite matrix (ABM) / cell binding peptide (P-15) bone replacement grafts in human intrabony defects. I clinical findings. J of Periodontol. 2002;73:123–8. [
PubMed]
12. Kreji CB, Bissuda NF, Farah C, Geenwell H. Clinical evaluation of porous and non –porous hydroxyapatite in the treatment of human periodontal bony defects. J Periodontol. 1987;58:521–8.
[PubMed]
13. Nery EB, Lee KK, Czajkowski S, Dooner JJ, Duggan M, Ellinger RF, и др. A veterans administration cooperative study of biphasic calcium phosphate ceramic in periodontal osseous defects. J Periodontol. 1990;61:737–44. [
PubMed]
14. Galgut PN, Waite JM, Brook Shaw JP, Kingston CP. A 4-year controlled clinical study into the use of a ceramic hydroxyapatite implant material for the treatment of periodontal bone defects. J Clin Periodontol. 1992;19:570–7. [
PubMed]
15. Bowen JA, Mellonig JT, Gray JL, Towle HT. Comparison of decalcified freeze dried bone allograft and porous particulate hydroxyapatite in human periodontal defects. J Periodontol. 1989;60:647–54. [
PubMed]
16. Reynolds MA, Aichelmann-Reidy ME, Branch Mays GI, Gunsolley JC. The efficacy of bone replacement grafts in the treatment of periodontal osseous defects. Ann Periodontol. 2003;8:227–65. [
PubMed]
17. Stahl SS, Froum SJ, Tarnow D. Human clinical and histologic responses to the placement of htr polymer particles in 11 intrabony lesions. J Periodontol. 1990;61:269–74. [
PubMed]
18. Meffert RM, Thomas JR, Hamilton KM, Brownstein CN. Hydroxyapatite as an alloplastic graft in the treatment of human periodontal osseous defects. J Periodontol. 1985;56:63–73. [
PubMed]